La glicosuria normo-glicemica del cane: l'approccio diagnostico mediante semplici algoritmi
Quando pensiamo ad un paziente con glicosuria, immediatamente la nostra mente ci rimanda al diabete mellito. Bisogna tuttavia ricordarsi che esistono anche forme di glicosuria non associate ad iperglicemia, che vengono pertanto definite normo-glicemiche (o euglicemiche). Cosa fare in questi casi? Ecco alcuni semplici step logici da seguire, riassunti tramite semplici algoritmi.
GLICOSURIA NORMO-GLICEMICA NEL CANE
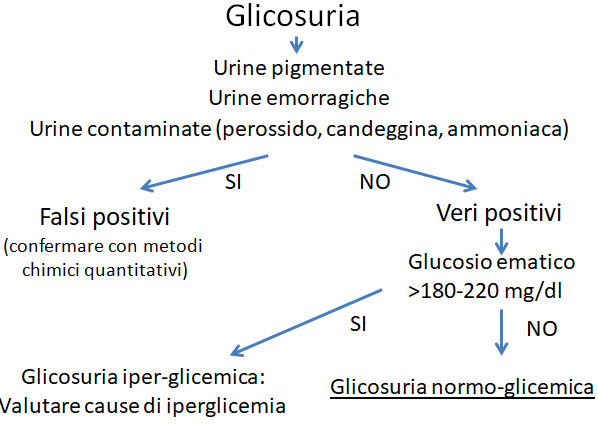
La misurazione semi-quantitativa del glucosio urinario è parte integrante dell‘esame-chimico fisico delle urine. L’eventuale presenza di glucosio deve essere interpretata alla luce della glicemia contestuale del paziente, per differenziare una glicosuria normo-glicemica da una glicosuria iper-glicemica.
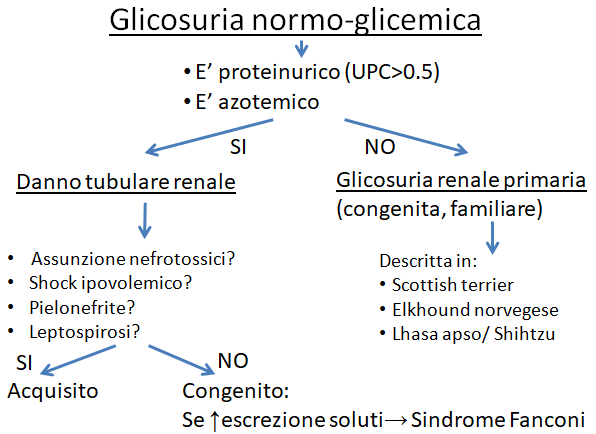
La glicosuria normo-glicemica riconosce la sua causa in una disfunzione del tubulo renale (tubulopatia), nella sua porzione prossimale, che comporta un mancato riassorbimento di glucosio a livello tubulare e quindi una conseguente perdita con le urine. Le tubulopatie possono essere primarie (di solito per disturbi ereditari) o acquisite (secondarie cioè a fenomeni di danno tubulare, di solito di origine tossica, ischemica o infettiva).
Figura 1. Il primo step è confermare che la glicosuria sia realmente normo-glicemica.
METODI DIAGNOSTICI
Nella pratica clinica, l’analisi delle urine viene effettuata con un metodo semi-quantitativo, tramite l’uso di strisce reattive (dipstick). La lettura è possibile grazie a una reazione colorimetrica, che fa virare il colore del “pad” della striscietta più o meno intensamente, a seconda della quantità di glucosio presente nel campione. Le strisce reattive possono essere interpretate visivamente o mediante specifici strumenti di lettura automatizzata, che possono ridurre gli errori interpretativi. I limiti inferiori di lettura nei kit in commercio sono estremamente variabili tra loro (da 20 mg/dL a 100 mg/dL). Infatti se misurata mediante metodiche di chimica clinica quantitative più sensibili, una piccola quantità di glucosio è rilevabile anche nelle urine di cani sani (vedi oltre). Solitamente la diagnosi di glicosuria si limita ad una positività alla reazione sulla striscietta urinaria (quindi per glicosuria >20 mg/dL).
Nonostante il test sia specifico per il glucosio, si possono ottenere dei risultati erronei come segue:
- Falsi negativi: possibili con urine analizzate a temperatura di refrigerazione. In questo caso la reazione enzimatica non avviene come dovrebbe.
- Falsi positivi (“pseudo-glicosuria”): causati dalla presenza di contaminanti come ipoclorito di sodio (candeggina) o ammoniaca, in pazienti in terapia con cefalexina, o per una prolunga esposizione della striscia reattiva all’aria.
Il metodo gold standard per misurare la concentrazione di glucosio è la chimica liquida in biochimica clinica, in grado di misurare concentrazioni inferiori rispetto al dipstick, fino a 2,5 mg/dl.
Utilizzando questo metodo analitico, un recente studio prospettico, ha dimostrato la presenza di una “glicosuria basale” nel cane, ovvero l’esistenza di una concentrazione fisiologica di glucosio in urine di cani sani (già dimostrata nella specie felina e nell’uomo). Tuttavia, sono necessari maggiori studi per poter definire dei valori di cut- off sufficientemente consolidati per poter parlare di normo-glicosuria (per valori normali) e iper-glicosuria (per valori patologici).
DIAGNOSI DIFFERENZIALI
Le tubulopatie responsabili di glicosuria normo-glicemica possono essere dovute a malattie ereditarie/congenite o a danni tubulari acquisiti. Vediamole nel dettaglio.
Figura 2. Una volta verificato che si tratta effettivamente di glicosuria normo-glicemica, bisogna cercare di stabilire le potenziali eziologie.
GLICOSURIA RENALE CONGENITA e/o EREDITARIA
La glicosuria renale primaria, considerata una condizione ereditaria benigna, senza gravi sequele cliniche: è causata da una mutazione genetica ancora in corso di studio. È una condizione rara, descritta per la prima volta nei cani norvegesi di razza Elkhounds, e successivamente nello Scottish terrier, nel Lhasa apso, nello Shihtzu, nel Basenji e in cani meticci. Si caratterizza per la presenza di glicosuria normo-glicemica persistente, in assenza di ulteriori alterazioni ascrivibili a un danno tubulare più complesso. Decorre solitamente in modo asintomatico e, quando clinicamente manifesta, si presenta con un’insorgenza giovanile caratterizzata da poliuria e polidipsia dovuta a diuresi osmotica. Poiché in caso di glicosuria persistente si verificano spesso infezioni del tratto urinario inferiori (UTI - batteriche e fungine), è importante effettuare un monitoraggio regolare delle urine. Non esiste alcuna cura, ma la prognosi a lungo tempo è buona.
In alcuni casi la glicosuria renale è, invece, il sintomo iniziale della “Sindrome di Fanconi”. La sindrome di Fanconi è un disturbo globale a carico del tubulo contorto prossimale, che impedisce il riassorbimento di glucosio, bicarbonati, aminoacidi, fosfati ed altri elettroliti e piccole molecole, con conseguente eccessiva escrezione urinaria di questi soluti. Sebbene ci siano forme ereditarie descritte in diverse razze, tra cui il Basenji, il Volpino di Pomerania, lo Shetland Sheepdog, l’IrishWolfhound e il Labrador Retriever, in cui questa tubulopatia sembra associarsi ad una epatopatia da accumulo di rame, la Sindrome di Fanconi non si associa sempre a un disturbo ereditario, come viene invece riportato nell’ uomo. Infatti, può instaurarsi secondariamente a insulto tubulare di natura tossica (es. avvelenamento da glicole etilenico, somministrazione di gentamicina), neoplastica (es. mieloma multiplo), conseguente a gammopatie monoclonali, o più frequentemente per un danno ischemico.
La Sindrome di Fanconi causa un’escrezione anormale di molti soluti. I segni clinici e laboratoristici sono quindi legati ad un patologico/inefficace riassorbimento renale di bicarbonati, amminoacidi, fosfati, elettroliti monovalenti, con possibili conseguenti alterazioni biochimiche sieriche ed urinarie. La valutazione della chimica urinaria in questi casi, può evidenziare una aumentata escrezione di diversi soluti (aumento delle “FE - Frazioni di Escrezione”). L’escrezione anormale di glucosio causa diuresi osmotica con conseguente poliuria. Durante la progressione della malattia, si verificano acidosi metabolica (per perdita dei bicarbonati), aminoaciduria, proteinuria (generalmente lieve), squilibri elettrolitici, disidratazione, rachitismo, osteomalacia, decifit di crescita e insufficienza renale.
Non esistendo una cura eziologica per questi difetti tubulari, la terapia è di supporto ed è mirata alla reintegrazione delle sostanze che vengono perdute per via renale. Il cane deve essere monitorato per l’eventuale acidosi metabolica, iperazotemia e UTI. Nelle forme secondarie il trattamento deve essere diretto alla risoluzione della causa sottostante. Se ben gestita dal momento della diagnosi, il tempo di sopravvivenza mediano è di cinque anni.
Figura 3. Riassunto delle tubulopatie familiari.

GLICOSURIA RENALE ACQUISITA
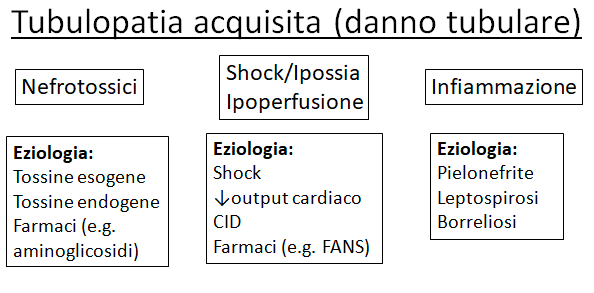
La glicosuria in assenza di iperglicemia è presente nel 25-50% dei cani con un danno renale acuto (AKI), secondario a diversi insulti a carico del tubulo prossimale, che impediscono il normale riassorbimento di glucosio. Le cause più frequenti di danno tubulare acquisito sono cause ischemiche e agenti nefrotossici, spesso presenti contemporaneamente. Le cause ischemiche includono ipotensione, ipovolemia, shock, vasocostrizione renale eccessiva o problematiche vascolari renali. La parte tubulare è la prima a risentire di una condizione ischemica, in quanto si tratta di una zona ad elevata attività metabolica, quindi con una grande richiesta di ossigeno ed energia. L’ingestione o la somministrazione iatrogena di agenti “nefrotossici”, determinano un danno tubulare, o agendo direttamente sul tubulo (es. aminoglicosidi), o provocando/aggravando l’ischemia renale (es. FANS).
Oltre a danni tossici e ischemici esistono anche cause infettive (es. pielonefrite batterica e leptospirosi) che per meccanismi di flogosi tubulo-interstiziale, comportano danni tubulari con possibile glicosuria. La leptospirosi è una malattia sistemica, che colpisce prevalentemente reni e fegato e durante la sua fase acuta le lesioni renali predominanti si manifestano come una nefrite interstiziale, con degenerazione delle cellule tubulari renali e, in alcuni casi, necrosi tubulare. La glicosuria normo-glicemica viene descritta in letteratura nel 30-50% dei cani con infezione da Leptospira. In uno studio recente, in particolare, la glicosuria normoglicemica era riportata nel 60% circa dei cani con AKI da leptospirosi: la frequenza e l’entità della glicosuria erano significativamente più gravi in questi soggetti rispetto a cani con AKI legata a cause diverse dalla leptospirosi.
Un’altra causa frequente di danno tubulare di origine infettiva è la pielonefrite; questa può essere l’esito di UTI ascendenti, o più raramente essere causata da batteri che giungono al rene per via ematogena. Le UTI ascendenti e le pielonefriti sono causate principalmente da batteri, tra cui i più comuni sono: Escherichia coli e Staphylococcus ssp., meno comuni Proteus, Streptococcus, Klebsiella, Enterobacter e Pseudomonas aeruginosa. La midollare renale è la parte più suscettibile alle infezioni a causa del ridotto afflusso di sangue e all’elevata osmolalità, che inibisce la funzione dei neutrofili, oltre ad un’elevata concentrazione di ammoniaca, che inibisce l’attivazione del complemento. A causa di questi fattori, dopo che è avvenuta la colonizzazione batterica delle pelvi, la midollare è facilmente aggredibile. I batteri possono provocare necrosi dell’epitelio tubulare e infiammazione.
La sintomatologia dei cani con glicosuria renale acquisita è aspecifica ed è legata al danno tubulare acuto, sebbene riconosca delle differenze a seconda della causa sottostante. I rilievi clinico-patologici più frequenti in questi cani sono iperazotemia di grado variabile (da assente in molti casi, fino a grave), oliguria/anuria, riduzione del PS urinario (PS <1030), proteinuria, cilindruria. In caso di pielonefrite sarà possibile osservare anche leucocituria e batteriuria. La terapia deve essere il più possibile mirata alla causa sottostante, ma deve essere spesso associata a terapia di supporto.
Figura 4. Riassunto delle tubulopatie acquisite.
Bibliografia:
- Appleman, E. H., Cianciolo, R., Mosenco, A. S., Bounds, M. E., & Al‐Ghazlat, S. 2008. “Transient acquired Fanconi syndrome associated with copper storage hepatopathy in 3 dogs.” Journal of veterinaryinternal medicine, 22(4), 1038-1042.
- Bekhof, J., Kollen, B. J., Groot-Jebbink, L. J., Deiman, C., Van de Leur, S. J., & Van Straaten, H. L. 2011. “Validity and interobserver agreement of reagent strips for measurement of glucosuria”. Scandinavian journal of clinical and laboratoryinvestigation, 71(3), 248-252.
- Bommer NX, Brownlie SE, Morrison LR, Chandler ML, Simpson JW. Fanconi Syndrome in Irish Wolfhound Siblings. J Am AnimHosp Assoc. 2018 May/Jun;54(3):173-178. doi: 10.5326/JAAHA-MS-6439
- Bouillon, J., Snead, E., Caswell, J., Feng, C., Hélie, P., &Lemetayer, J. 2018. “Pyelonephritis in dogs: retrospective study of 47 histologically diagnosed cases (2005–2015)”. Journal of veterinary internal medicine, 32(1), 249-259.
- Carmichael, N., Lee, J., &Giger, U. 2014. “Fanconi syndrome in dog in the UK.” Veterinary Record, 174(14), 357-358.
- Chew, D. J., DiBartola, S. P., &Schenck, P. 2010. Canine and Feline Nephrology and Urology. Elsevier Health Sciences.
- Cooper, G. R. “2013”. Standard Methods of Clinical Chemistry: By the American Association of Clinical Chemists.
- Ettinger, S. J., Feldman, E. C., & Cote, E. 2017. Textbook of Veterinary Internal Medicine.
- Langlois DK, Smedley RC, Schall WD, Kruger JM. Acquired proximal renal tubular dysfunction in 9 Labrador retrievers with copper-associated hepatitis (2006-2012). J Vet IntMed. 2013;27:491-499.
- Ross, L. 2011. “Acute kidney injury in dogs and cats”. Veterinary Clinics: Small Animal Practice, 41(1), 1-14.
- Schuller, S., Francey, T., Hartmann, K., Hugonnard, M., Kohn, B., Nally, J. E., & Sykes, J. 2015. “European consensus statement on leptospirosis in dogs and cats”. Journal of Small Animal Practice, 56(3), 159-179.
- Zeugswetter FK, Schwendenwein I. Basal glucose excretion in dogs: The impact of feeding, obesity, sex, and age. Vet ClinPathol. 2020 Sep;49(3):428-435. doi: 10.1111/vcp.12899
- Zamagni, R. Troìa, F. Zaccheroni, E. Monari, C. Grisetti, L. Perissinotto, A. Balboni, F. Dondi. Comparison of clinicopathological patterns of renal tubular damage indogs with acute kidney injury caused by leptospirosis and otheraetiologies. The Veterinary Journal 266 (2020) 105573http://dx.doi.org/10.1016/j.tvjl.2020.105573
Francesco Dondi, Med. Vet. Università di Bologna, consulente di MYLAV.
Walter Bertazzolo, EBVS European Specialist in Veterinary Clinical Pathology (Dipl. ECVCP); Direttore Scientifico di MYLAV.
Commenti
- Nessun commento trovato








Lascia i tuoi commenti
Login per inviare un commento
Posta commento come visitatore